La ferroptosis, unartículo publicado en la revista Cell, ofrece unavisión profunda de esta área de investigación emergente

Brent R. Stockwell, el autor que originó el concepto de ferroptosis, ha escrito una reseña sobre el progreso dela investigación en el 10.º aniversario dela ferroptosis, publicada en la revista Cell, conun alto factor de impacto de 66.85 (2022). Los proyectos financiados por la FundaciónNacional deCiencias Naturales y el monto de dinero adjudicado en esta dirección estánaumentando año tras año, y los artículos de investigación relevantes también estánalcanzandorepetidamente los primeros lugares en CNS (Figura 1).

Figura 1. Hitos clave y crecimiento de laliteratura sobre la muertepor hierro a lo largo del tiempo
La ferroptosis es una forma de muerte celular dependiente delhierro yla peroxidación lipídica. Esto puede evaluarse en cultivoscelularesprobando si los quelantes de hierro y los antioxidantes lipofílicos inhiben lamuerte celular.
I. Tres áreas principales de investigación sobreferroptosis:fundamentos metabólicos, control de especies reactivas de oxígeno, regulacióndel hierro.
1.Los mecanismos de metabolismo deaminoácidosy lípidos proporcionan la base para la ferroptosis.
La reducción de la cistina oxidada conduce ala muertecelular dependiente de glutatión (GSH) y puede prevenirse con el tratamiento convitamina E. Los fosfolípidos (PLs), un componente clave de las membranas, cuandoestánpresentes en los lípidos de la membrana, la porción de PUFA puedeactuar como un sustrato necesario para la peroxidación en la ferroptosis.
2.Los investigadores han elucidadolaimportancia biológica del daño oxidativo de las biomoléculas.
El sistema Xc- actúa como un anti-transportador de entrada de cistina, un componente aminoácido clave del GSH, que previene el"estrés oxidativo"causado por oxidantes como el peróxido de hidrógeno. La glutatión peroxidasa 4 (GPX4), una proteína de selenio, es un inhibidor central de la ferroptosisy actúa como una peroxidasa dependiente de GSH para combatir la oxidación delípidosen las membranas. La erastina induce la ferroptosis al bloquear la captación decistina por el sistema Xc-, lo que lleva al agotamiento de cisteína yGSH, y el objetivomolecular de RSL3 es GPX4, controlando una forma de muerte celular oxidativanoapoptótica.
3.La importancia del hierro y la regulación delhierro.
Fenton informó que las sales de hierro reaccionabanconperóxidos para formar radicales hidroxilo, proponiendo la reacción que ahora lleva su nombre (Fe 2+ + HOOH → Fe 3+ + OH - + OH⋅).El principal mecanismo de transporte de hierro es en la forma de transferrina (Tf). Juntocon eldescubrimiento de la proteína exportadora de hierro ferroportina, estos estudioshan sentado las bases para nuestra comprensión de la homeostasis delhierro.

Figura 2. Mecanismos de la ferroptosis
● La inactivación de la acil coenzima A (CoA) sintetasa de cadena larga miembro 4 (ACSL4) y la lisofosfatidilcolina aciltransferasa 3 (LPCAT3) hizo que estas células fueran resistentes a dos inhibidoresdiferentes de GPX4: RSL3 y ML162. La sobreexpresión de ACSL4 aumenta la sensibilidadala ferroptosis. La familia de enzimas ACSL es esencial para laferroptosis, y la activación de ácidos grasos a ésteres de CoA es un paso regulador clave en la ferroptosis. La biosíntesis de PUFA es en sí misma un medio pararegular la susceptibilidad ala ferroptosis: activando la proteína quinasa activada por adenosinamonofosfato (AMPK) para impulsar la resistencia a la ferroptosis y controlando lacarboxilasa de acetil-CoA (ACC) para restringir la biosíntesis de PUFA. En resumen, los lípidoslocalizados en la membrana que contienen PUFA son impulsores dela ferroptosis, incluidos PL, lípidos éter y otros lípidos derivados del glicerol.
● Los ácidos grasos monoinsaturados (MUFA), comoel ácido oleico, requieren ACSL3 para sus efectos anti-ferroptosis.
● El gen de resistencia a múltiples fármacos MDR1 aumenta la sensibilidad a la ferroptosis al causar la pérdida de GSH,mientras que laenzima catabólica de cisteína, cisteína dioxigenasa 1 (CDO1), aumentala sensibilidad ala ferroptosis al descomponer la cisteína y luego consumir GSH.
● El compuesto FIN56 induce la degradación de GPX4 y aumenta la sensibilidad a la ferroptosis al sobreagotar la coenzima Q10 (CoQ10) enla vía del mevalonato.
● GPX4 controla de manera independiente la acumulación de ROS lipídicas. Sin embargo, en los últimos años, se han identificadotres sistemaspara inhibir la ferroptosis que no dependen de GPX4. La proteína supresora de ferroptosis 1 (FSP1)/CoQ10, la deshidrogenasa del ácidodihidroorótico (DHODH) y la hidrolasa de ciclinación de GTP 1 (GCH1)/tetrahidrobiopterina (BH4) inhiben la ferroptosis de manera independiente de GPX4.Las células conalta expresión de GCH1 o DHODH eran más resistentes a la ferroptosis, mientras que las células con baja expresión eran más sensibles a la ferroptosis.
● La aminoácido oxidasa inducida por interleucina-4 (IL4i1), originalmente identificada en células B como un gen que responde a la inducción de IL-4, produce el metabolito indol-3-piruvato (In3Py), que inhibe el mecanismo de eliminación de la ferroptosis a través de radicales libres yunperfil de expresión génica coordinado para atenuar la ferroptosis.
● La peroxidación de lípidos que contienenPUFA es impulsada por un reservorio de hierro intracelular, y el hierro activodesencadena lareacción de Fenton, que inicia la formación de peróxidoslipídicosque son sustratos para la reacción de Fenton al desencadenar la peroxidación de lípidos, así comola producción de enzimas dependientes de hierro como laslipoxigenasas delácido araquidónico (ALOXs). Estos peróxidos lipídicos son sustratos para la reacción de Fenton. La 15-lipoxigenasa puede complejarse con la proteína 1 de unión a PE (PEBP1) para catalizar específicamente el sustrato de la enzima desde PUFA libre hasta PUFA-PL. Además, la ferroptosis dependiente de p53requiere la 12-lipoxigenasa.La citocromo P450 oxidoreductasa (POR) también contribuye a la peroxidación de lípidos durante la ferroptosis, lo que sugiere que varias enzimas quecontienen hierro tienen la capacidad de promover la peroxidación de lípidos que conduce a la ferroptosis.
● Otros mecanismos que controlan la abundancia dehierro en la célula influyen en la sensibilidad de la célula a la ferroptosis: la salida de hierro mediada por ferroportina o por el complejo de ferritina deprominina-2 (prom2) mejora la resistencia de la célula a la ferroptosis, ya que esto agota el hierro en la célulapara reducir la capacidad de peroxidación de lípidos.
● Erastina y RSL3 representan las dos primeras clases de compuestos inductores de la muerte por hierro que actúan inhibiendo la captación de cistina a través del Sistema Xc- y GPX4, respectivamente. FIN56 induce la degradaciónde GPX4 como un tercer compuesto, FINO2 representa la cuarta clase de compuestos inductores de ferroptosis, y FINO2 oxida Fe(II) a Fe(III): los agentes quelantes dehierro inhiben de manera más efectiva su actividad letal. La distribución más amplia de lípidos oxidados detectados después del tratamiento con FINO2 en células quedespués del tratamiento con erastina sugiere que FINO2 reacciona con Fe(II) en una reacción de Fenton para producir radicales alcoxi que inician directamente la peroxidación de lípidos.
● Se han identificado tres mecanismos principales de resistencia a la ferroptosis: el regulador antioxidante NRF2,la vía de la transulfuracióny el objetivo mecanicista de la rapamicina (mTOR).

Figura 3. Funciones fisiológicas de la ferroptosis
Un avance clave en la búsqueda de los procesos biológicos involucrados en la ferroptosis ha sido el descubrimiento de marcadores para detectar la ferroptosis. Dado que la ferroptosis es impulsada por la peroxidación lipídica dependiente del hierro, la detección de tales eventos de peroxidaciónlipídica durante la ferroptosis es esencial (Figura 4). Además, las mitocondrias suelen mostrar una morfología encogida y densa durante la ferroptosis, y se pueden detectar cambios específicos en la expresión génica. La regulación al alza del TfR1y su movimientohacia la membrana plasmática marcan a las células muertas por hierro. Usando estos marcadores, se han descubierto muchas de las funciones fisiológicas naturales de esta antigua forma de muerte celular.
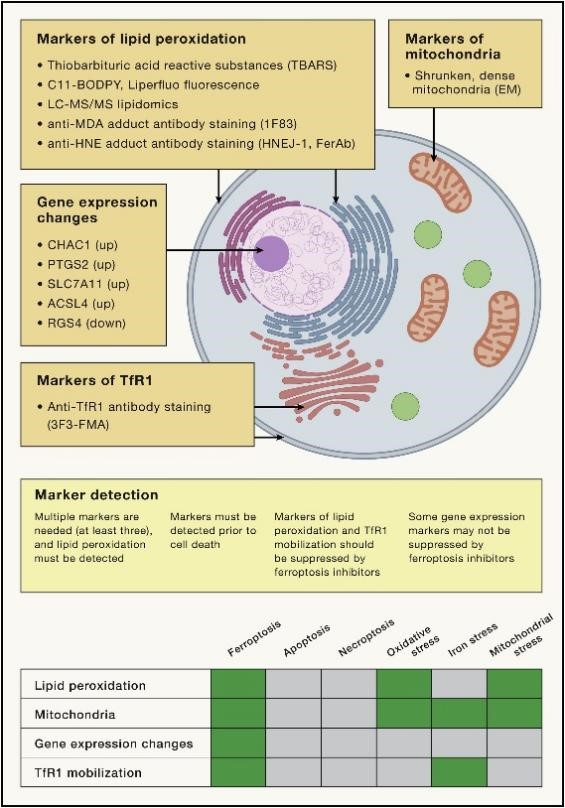
Figura 4. Marcadores de la ferroptosis
Además de las funciones fisiológicas normales de la ferroptosis descritas anteriormente, la ferroptosis también está asociadacon muchas patologías (Figura 5).

Figura 5. Rol de los orgánulos y órganos en la ferroptosis
1. Enfermedad por sobrecarga de hierro
Un informe reciente encontró queratones alimentadoscon una dieta alta en hierro y ratones con mutaciones asociadas conla hemocromatosis hereditaria desarrollaron daño hepático en los marcadores deferroptosis, lo cual fue revertido por inhibidores de ferrostatina 1.
2. Daño orgánico
Un estudio reciente informa que el síndrome de disfunción multiorgánica (MODS) es común en pacientes críticamente enfermos en unidadesde cuidados intensivos (UCIs) y está relacionado con la ferroptosis. Los niveles plasmáticos de hierro catalizado y malondialdehído (un marcador de peroxidación lipídica) en 176 pacientes adultos críticamente enfermos se correlacionaron positivamentecon las puntuaciones de la Evaluación Secuencial de Fallo Orgánico (SOFA).Además, la administración de sulfato de hierro a ratones resultóen daño multiorgánico, elevando los marcadores de daño en riñón, hígado, músculo, corazón y plasma,lo cual fue atenuado por inhibidores de la ferroptosis (por ejemplo, vitamina E). Por lo tanto, inhibir la ferroptosis puede ser una estrategia viable para prevenir el daño multiorgánico en un entorno de cuidadosintensivos.
3. Degeneración retiniana
Las células epiteliales pigmentarias dela retina experimentan degeneración y muerte durante enfermedades retinianas(por ejemplo, degeneración macular relacionada con la edad). Las nanopartículas de azul dePrusia pueden inhibir la muerte de estas células.
4. Neurodegeneración
Numerosos informes han vinculado la ferroptosis con una variedad de enfermedades neurodegenerativas, incluidas la enfermedadde Huntington (HD), la enfermedad de Alzheimer (AD), la enfermedad de Parkinson (PD) y la esclerosis lateral amiotrófica (ALS). Un tratamiento preclínicoy clínicamente efectivo para ALS, CuII(atsm), inhibe la ferroptosis.
5. Enfermedades infecciosas
La hepatitis C es una causa principal deenfermedad hepática, y la replicación del virus de la hepatitis C está limitada por la activación de la ferroptosis en las células huésped.
El síndrome respiratorio agudosevero porcoronavirus 2 (SARS-CoV-2) puede activar la ferroptosis durante la infección.
La infección por M. marinae en peces cebra esinhibida por la hemo oxigenasa 1 (HMOX1), que regula ladisponibilidad de hierro en el hemo a través del tratamiento con ferrostatina 1.
La ferroptosis mejora la infección por Pseudomonas aeruginosa.
6. Enfermedades autoinmunes
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune asociada con la activación de la ferroptosis en neutrófilos. El asma, que implica una sobreactivación de la respuesta inmune, puede desencadenarse o empeorarpor la ferroptosis en células epiteliales de las víasrespiratorias que liberan ADN mitocondrial inmunogénico. La ferroptosis, cuando ocurre en neutrófilos o célulasepiteliales de las vías respiratorias, conduce a una activación inmune excesiva, resultando en enfermedades autoinmunes.
7. Tumores
Aunque se ha informado que la ferroptosis funciona comoun mecanismo supresor de tumores, la pérdida de ferroptosis puede impulsar la tumorogénesis. Las selenoproteínas son predictores del riesgo de cáncery el selenio está elevado en el tejido tumoral, lo que sugiereuna abundancia y actividad elevadas de GPX4 en la tumorogénesis.
Ⅴ. Aplicaciones terapéuticas de la ferroptosis
Actualmente, monitorear la peroxidación lipídica es una forma de reconocer la presencia de ferroptosis.Losmétodos para detectar la peroxidación lipídica incluyen el uso de un ensayo de sustancias reactivas al ácidotiobarbitúrico (TBARS) para la detección de productos oxidados ode peroxidación lipídica de isoprostano por LC-MS/MS, sondas fluorescentes C11-BODIPY, y anticuerposque reaccionan con productos de peroxidación lipídica, como el anticuerpo anti-HNE FerAb, el anticuerpo HNEJ-1, y el anticuerpo anti-aducto de malondialdehído (MDA) 1F83, el anticuerpo 3F3-FMA, y otros anticuerpos anti-TfR1para la detección. Varios genes, como CHAC1, PTGS2, SLC7A11, y ACSL4, se inducen durante la ferroptosis, mientras que RGS4 se regula negativamente durante la ferroptosis. La expresión alterada de estos genespuede detectarse mediante qPCR como un indicador de ferroptosis.
1. Promotores de la ferroptosis
Como una forma de muerte celular, la ferroptosispodría utilizarse potencialmente para eliminar tipos celulares problemáticos, como células cancerosas, células inflamatorias o fibroblastos activados.Se han identificado cuatro mecanismos amplios para inducir la ferroptosis: (1) inhibición delSistema Xc-, (2) inhibición/degradación/inactivación de GPX4, (3) agotamiento de CoQ10 reductiva, y (4) inducción por lípidos: peroxidación a través de la sobrecarga de peróxidos, hierro o ácidos grasos poliinsaturados (PUFA).
● La inhibición del Sistema Xc- es un mecanismo potente para inducir la ferroptosis: múltiples inhibidores de moléculas pequeñas estructuralmente distintos de esta proteína anti-translocadora, como erastina,sulfasalazina y Glu, inhiben el Sistema Xc- e inducen la ferroptosis.
● La reducción de cisteína elimina los sustratosextracelulares del Sistema Xc- e induce la ferroptosis.
● La inactivación génica o la inhibición odegradación mediada por moléculas pequeñas de GPX4 induce la ferroptosis en muchos tipos celulares.
● La inhibición de la biosíntesis deCoQ10 a través de la vía del mevalonato y la inactivación de lasreductasas de CoQ10 (p. ej., AIFM2/FSP1 o DHODH) inducen la ferroptosis.
● La ferroptosis puede inducirse medianteel tratamiento con exceso de hierro, PUFA o peróxidos (como tBOOH o FINO2).
2. Inhibidores de la ferroptosis
● Ferrostatina-1 y liproxstatina como agentes captadores de radicales libres para inhibir la propagación de la peroxidación lipídica.
● El fármaco para reducir el colesterol, probucol,inhibe la ferroptosis y es eficaz en un modelo de toxicidad por Glu.
● Necrostatina-1 (nec-1) es un inhibidor de RIPK1que inhibe la necroptosis.
● La administración deselenio inhibe la ferroptosisdurante un accidente cerebrovascular.
● El óxido nítrico dirigido a las mitocondrias, XJB-5-131, inhibe la apoptosis y la ferroptosis.
















Comentarios