Puromycin dihydrochloride (Synonyms: CL13900) |
| Catalog No.GC16384 |
Puromycin dihydrochloride es producido por Streptomyces alboniger, un actinomiceto grampositivo, a través de una serie de reacciones enzimáticas.
Products are for research use only. Not for human use. We do not sell to patients.
Cas No.: 58-58-2
Sample solution is provided at 25 µL, 10mM.
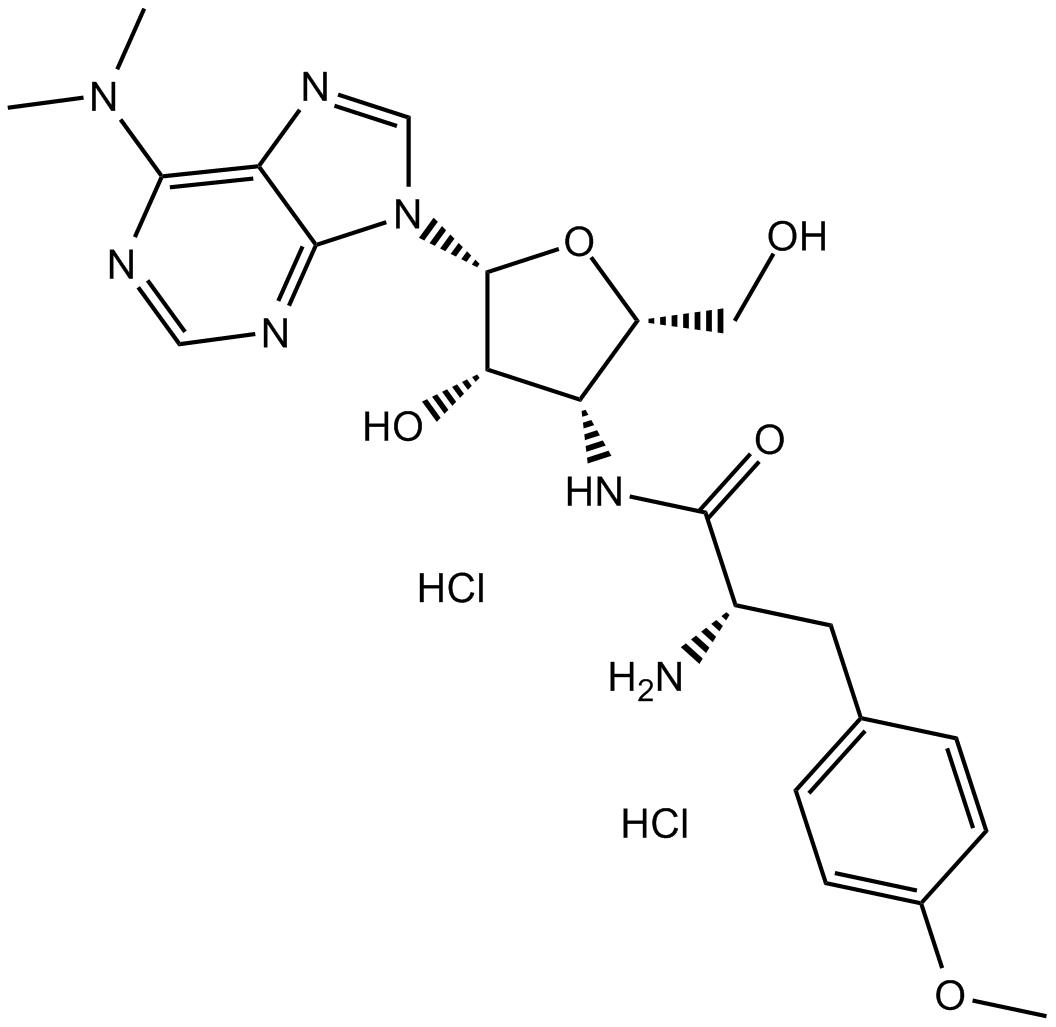
Puromycin dihydrochloride es producido por Streptomyces alboniger, un actinomiceto grampositivo, a través de una serie de reacciones enzimáticas.[1] Puromycin dihydrochloride incluye un nucleósido covalentemente unido a un aminoácido, imitando el extremo 3' de los tRNA aminoacilados que participan en la entrega de aminoácidos a los ribosomas en elongación.[2] Inhibe el crecimiento de células animales y bloquea la síntesis de proteínas uniéndose a los ribosomas 80S a bajas dosis.[3]
Un estudio in vitro determinó la concentración óptima de Puromycin dihydrochloride para seleccionar células transfectadas con EGFPac realizando una prueba de resistencia a Puromycin dihydrochloride. El gen resistente a puromicina (denominado pac) que codifica la puromicina N-acetil transferasa fue aislado de Streptomyces alboniger. Si pac es introducido y expresado en células animales, las células pueden sobrevivir en presencia de Puromycin dihydrochloride. Los resultados mostraron que se pudo producir con éxito un lechón transgénico clonado somáticamente utilizando células recombinantes obtenidas después de la transferencia de un transgén (que lleva tanto las unidades de expresión EGFP como pac) y la posterior selección in vitro con una baja concentración (2 mg/ml) de puromicina.[3]
Se realizó un estudio in vivo para determinar si la técnica de detección de superficie de la traducción (SUnSET) podría usarse para medir la síntesis de proteínas en tejidos completos. Dado que actualmente hay un intenso interés en identificar los mecanismos moleculares que regulan la síntesis de proteínas en el músculo esquelético, esta técnica permite la visualización y cuantificación de la síntesis de proteínas y elimina la necesidad de generar tejidos/animales radiactivos. Este estudio también determinó que la detección de superficie de la traducción podría detectar cambios relativamente agudos en la síntesis de proteínas en ausencia de cambios en el rRNA, así como detectar no solo aumentos, sino también disminuciones en la síntesis de proteínas in vivo.[4]
References:
[1]. Tercero JA, Espinosa JC, Lacalle RA, Jiménez A. The biosynthetic pathway of the aminonucleoside antibiotic puromycin, as deduced from the molecular analysis of the pur cluster of Streptomyces alboniger. J Biol Chem 1996;271(3):1579–90.
[2]. Aviner R. et al. The science of puromycin: From studies of ribosome function to applications in biotechnology. Comput Struct Biotechnol J. 2020 Apr 24;18:1074-1083.
[3]. Watanabe S, Iwamoto M, et al. A novel method for the production of transgenic cloned pigs: electroporation-mediated gene transfer to non-cultured cells and subsequent selection with puromycin. Biol Reprod. 2005 Feb;72(2):309-15.
[4]. Goodman CA, Mabrey DM, et al. Novel insights into the regulation of skeletal muscle protein synthesis as revealed by a new nonradioactive in vivo technique. FASEB J. 2011 Mar;25(3):1028-39.
Average Rating: 5 (Based on Reviews and 35 reference(s) in Google Scholar.)
GLPBIO products are for RESEARCH USE ONLY. Please make sure your review or question is research based.
Required fields are marked with *




